
Factores que inciden en la reacción química
Anteriormente habíamos estado hablando acerca de la incidencia de la temperatura en las reacciones químicas que suceden a nuestro alrededor, pero es de resaltar que esta no es la única que influye en dichos procesos, existen un sinnúmero de catalizadores incidentes en aquellas reacciones que día a día tenemos la oportunidad de observar. En las últimas clases hemos venido trabajando en un proceso de observación y reconocimiento, en donde gracias a los conceptos previos del área y las prácticas realizadas en clase, pudimos identificar como interaccionan algunos componentes en procesos químicos que iban desde los más simples hasta los más complejos. Y en esta clase, logramos llevar a cabo unos experimentos que dejaron en evidencia como unas simples sustancias desembocan la iniciación de algunas reacciones químicas que nos ayudaran a comprender con mayor claridad la función de estas, mejor conocidas como catalizadoras, que influyen en el aumento de la velocidad en las reacciones químicas, mediante un componente energético potenciador de dicho proceso.
Para llevar a cabo los experimentos tuvimos que requerir de algunos materiales tales como el peróxido de hidrogeno, el óxido de manganeso, y una patata normal. Pues bien, sabemos que el peróxido de hidrogeno es un compuesto químico con características de un líquido altamente polar, fuertemente enlazado con el hidrógeno tal como el agua, que por lo general se presenta como un líquido ligeramente más viscoso que esta. El dióxido de manganeso es muy oxidante, siendo este el óxido más importante del grupo de los metales, pero no el más estable. Y la patata producto del alargamiento de las células parenquimáticas y la pérdida de la polaridad de las mismas.
Antes de dar inicio al experimento, comenzamos a suponer que podría pasar al reaccionar el peróxido de hidrogeno con el óxido de manganeso y la patata. Era un poco lógico para nosotros pensar que esta reaccionaria solo con el óxido de manganeso, debido a que este poseía algunas características que lo hacía sumamente inflamable al contacto con otras sustancias de tales cualidades, y por el contrario, la idea de que el peróxido de hidrogeno generara alguna reacción al hacer contacto con la patata era más que ridículo. Pero gran sorpresa nos llevamos al ver lo que ocurrió con ambas reacciones.
En el primer experimento que se llevó a cabo, vertimos un poco de peróxido de hidrogeno en un recipiente de vidrio, en el cual posteriormente introducimos algunos trozos de patata. Pasado algunos segundos comenzamos a observar que de estos se desprendían unos gases que ascendían a la superficie, para después esparcirse en el aire, no sin antes formar una espuma en la superficie de la sustancia. Pudimos observamos que la reacción fue inmediatamente intensa y persistente, hubo desprendimiento de calor, y las enzimas de la papa reaccionaron con el agua oxigenada. En el segundo experimento pasó algo aún más emocionante, al introducir el óxido de manganeso en el peróxido de hidrogeno, este inmediatamente reaccionaria para dar inicio a un consumo parcial y posteriormente total del peróxido de hidrogeno, manteniendo la sustancia del óxido de manganeso sin alteraciones más graves que un cambio físico de solido a líquido. Pero mediante avanzaba la reacción nos dimos cuenta que esta aumentaba su temperatura a lo largo del tiempo notándose que mientras más transcurría el tiempo el calor emanado de la sustancia aumentaba.
Ahora bien, a nivel submicroscópico, lo que sucedió con el primer experimento en donde introducimos algunos trozos de patata en el peróxido de hidrogeno, se debió a que las catalasas de la papa comenzaron a interaccionar como factor incidente entre el oxígeno y el peróxido de hidrogeno, provocando así, que esta reacción se diera con mayor velocidad, es decir, que la papa cumplió la función de sustancia catalizadora, ya que sus catalasas incidieron debilitando los enlaces intramoleculares del agua oxigenada, haciendo que esta pasara de una sustancia compleja como lo es el peróxido de hidrogeno, a dos sustancias simples como lo son el agua y el oxígeno. Provocando así, que al cabo de un rato nuestra sustancia inicial se consumiera completamente, dejando como producto, una cantidad considerable de agua y oxígeno.
Nosotros sabemos que un catalizador es una sustancia que, incluso en cantidades muy pequeñas, modifica enormemente la velocidad de una reacción química, sin que ella misma sufra un cambio químico permanente en el proceso. Así que, consideremos la descomposición del peróxido de hidrógeno (agua oxigenada) en agua y oxígeno. En ausencia de catalizadores esta reacción se realiza muy lentamente. Muchas diferentes sustancias son capaces de catalizar la reacción, entre ellas el dióxido de manganeso.
La adición de dióxido de manganeso de la pila causa la descomposición del agua oxigenada para dar agua y burbujas de oxígeno. Y podemos determinar fácilmente que la reacción es exotérmica, debido a que esta desprende energía en el proceso de la reacción, y por este motivo el vaso se calienta. Deduciendo así, que los catalizadores proporcionan un camino alternativo para la reacción química, alterando la velocidad de la misma, pero no se consumen. Es por eso que al final de la reacción se observa que el dióxido de manganeso permanece en el fondo del recipiente.
Podemos concluir entonces, que Tal vez esto de los catalizadores parezca algo raro o insólito, pero la verdad es que están presentes en nuestras vidas más de lo que imaginamos. Por ejemplo, cuando nos subimos a un automóvil, el mismo posee un catalizador en su sistema de escape de gases el cual se encarga de realizar las catálisis necesarias para reducir o eliminar gases tales como el monóxido de carbono, óxidos de nitrógeno, etc. En biología los catalizadores más significativos son las enzimas. Y estas encuentran su mayor participación en la catálisis del metabolismo y el catabolismo. Así que como podemos ver, los catalizadores se encuentran alrededor de nuestro ambiente, proporcionando un medio propicio para la realización y culminación de las diferentes reacción químicas.
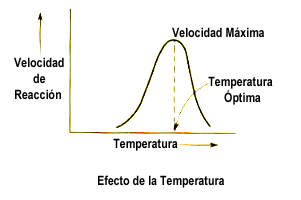
Como bien sabrán, en las últimas clases hemos venido tratando el tema de la temperatura como factor que incide en la velocidad de las reacciones químicas, siendo este nuestro tema principal de estudio en estos momentos. Pero el día de hoy por fin hemos llevado la teoría a la práctica con un experimento que nos ha demostrado que la temperatura cumple un papel muy importante en una reacción química, ya que esta se involucra directamente con este proceso. Y nuestro experimento dará alusión a ello con un proceso que consistirá en la disolución de una pastilla efervescente en un vaso de agua a una temperatura de 25°C y otro a una temperatura de 4°C.
Pero antes de dar inicio al experimento, bien podríamos suponer lo que estaría a punto de suceder. Ya conocemos algunos conceptos orientados a este tema tan interesante, por lo cual se nos facilita predecir lo que pasara con nuestra sustancia inicial al reaccionar con un mismo solvente en condiciones de temperatura diferentes. Ahora bien podemos decir que al reaccionar la primera pastilla en agua a 25°C esta se disolvería completamente en menor tiempo que la que estará en contacto con el agua a 4°C, ya que la temperatura incidiría en este caso aumentando la velocidad de reacción del primer proceso.
Posteriormente pudimos observar con gran entusiasmo que nuestra hipótesis no estaba muy alejada de la realidad. Ya que una vez introducidas las pastillas efervescentes en ambos vasos, pudimos observar que como bien lo habíamos dicho anteriormente, la pastilla que primero se disolvió fue la que se encontraba en el vaso de mayor temperatura. Esto demuestra la gran incidencia que posee la temperatura en la reacción, pero esto es solo lo que pudimos notar a nivel macroscópico ¿Pero, que estaría pasando en ese momento a nivel submicroscopico? ¿Cómo se comportarían las diferentes moléculas de ambas sustancias al reaccionar con ayuda de la temperatura?
Pues bien, a nivel submircoscopico en la reacción química, los enlaces entre los átomos que forman los reactivos se rompen. Entonces, los átomos se reorganizan de otro modo, formando nuevos enlaces y dando lugar a una o más sustancias diferentes a las iniciales. Pero la pregunta es, ¿Cuál sería la participación de la temperatura en esto? Verán, Para que se produzca la reacción es necesario que las moléculas de los reactantes choquen entre sí, ya que es la única manera de que puedan intercambiar átomos para dar lugar a los productos. Ésta es una condición necesaria pero no suficiente, ya que el choque debe darse con una mínima energía para que los enlaces de los reactivos se puedan romper, y con la orientación que les permita unirse para formar las moléculas de los productos. E aquí en donde comienza actuar la temperatura, ya que al aumentar esta, aumenta el número de moléculas con una energía igual o mayor que la energía de activación, con lo que aumenta el número de choques efectivos. Y así, la velocidad de la reacción se duplica por cada 10ºC de aumento de temperatura.
Por último, la razón del burbujear de la pastilla efervescente se debe que Entre los ingredientes de los comprimidos efervescentes se encuentran el bicarbonato sódico y un ácido orgánico. Que al entrar en contacto con el agua, el carbonato sódico se disocia en dos iones: el ion hidrogenocarbonato (HCO3) y el ion sodio (Na+). El primero reacciona con el ácido de la pastilla y da lugar, entre otros compuestos, al dióxido de carbono (CO2), gas que forma pequeñas burbujas ascendentes y que explotan al entrar en contacto con el aire.
En conclusión, La temperatura es un factor incidente en muchas de las reacciones químicas que se presentan en la naturaleza, las cuales son vital para la existencia de un sinnúmero de organismos vivos y para mantener el equilibrio de los fenómenos que suceden a nuestro alrededor. Por ello esta es tomada como un objeto de estudio clave para el análisis de varios fenómenos presentes en el mundo de la ciencia.

