TEORÍA DE LAS COLISIONES Y COMPLEJO ACTIVADO
A lo largo de este año lectivo nos hemos visto expuestos a un montón de información tanto práctica como teórica, que nos ha llevado a aumentar nuestros conocimientos en el área de química. Pero hoy, deseamos compartirle el gran avance que hemos tenido combase a un nuevo tema de área que nos ha llevado a dar un gran paso en el ámbito de la química, el cual es la teoría de las colisiones y el complejo activado. Una teoría que no solo explica el fenómeno de las reacciones químicas, sino que además expresa como la temperatura y diversos catalizadores influyen en la velocidad e iniciación de una reacción química.
Pues bien, cuando nos hacemos referencia a la teoría de las colisiones y el complejo activado, estamos hablando de un proceso basado en los continuos choques realizados por las moléculas reaccionantes, las cuales colisionan entre sí con una determinada velocidad rompiendo sus enlaces intramolesculares, para así reorganizarse formando unos determinados productos. Estas colisiones resultan ser exitosas cuando poseen la energía suficiente al momento del impacto, para romper los enlaces existentes y formar nuevos enlaces, resultando en los productos de la reacción. Pero cuando un catalizador está involucrado en la colisión entre las moléculas reaccionantes, se requiere una menor energía para que tome lugar el cambio químico, y por lo tanto más colisiones tienen la energía suficiente para que ocurra la reacción. Así que la velocidad de reacción por lo tanto también se incrementa.
Entonces, ya con esto, podemos definir el complejo activado como la cima de la barrera energética que requiere una reacción química para llevarse a cabo. Es decir, que es la energía suficiente para que se realice una reacción con una determinada velocidad que suele variar dependiendo de los factores externos incidentes en la reacción, como la temperatura, la presión, etc.
Decimos que una reacción exotérmica es cualquier reacción química que desprenda energía, ya sea como luz o calor, en esta reacción la cantidad de energía de los productos es menor a la de los reactivos, debido al desprendimiento de energía potencial a medida que avanza la reacción.
Por el contrario, una reacción endotérmica es aquella que absorbe energía y en cual la energía que poseen los productos es mayor a la de los reactivos, como consecuencia de su consumo en el proceso de ruptura de los enlaces intramolesculares y reformación de los átomos, para dar origen a unos determinados productos.


REACCIONES QUIMICAS REVERSIBLES
Nosotros sabemos que la mayor parte de las reacciones químicas terminan cuando la cantidad de reactivos se consumen completamente para dar como resultado unos determinados productos. Pero algunos procesos no se completan totalmente. El hecho de que esto suceda puede ser explicado por la reversibilidad de la reacción. Es decir, que luego de formar los productos, estos vuelven a formar los reactivos originales. Y si ciertas modificaciones no fuesen alteradas, estas sencillamente no llegarían a su fin.
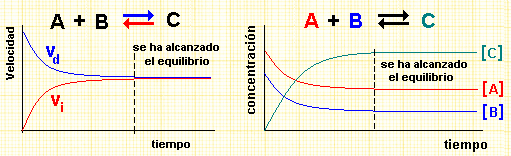
Debemos tener en cuenta que una reacción reversible no es más que una reacción que ocurre simultáneamente en ambos sentidos. Al mismo tiempo los reactivos se transforman en productos y los productos se transforman en reactivos. Es decir que los productos que se forman interactúan entre sí para reaccionar en sentido inverso y regenerar los productos. Luego de cierto tiempo, la velocidad de reacción directa e inversa se iguala, estableciéndose entonces el equilibrio químico.
Cuando se lleva a cabo una reacción química, al inicio de esta, existe una gran cantidad de reactivos dispuestos y apunto de interaccionar entre sí. Y a medida que el tiempo va pasando, esta cantidad va disminuyendo junto con la velocidad de la reacción. Por consiguiente en el inicio de la reacción aún no hay productos formados. Pero en el transcurso de esta, se lleva a cabo la formación de unos determinados productos los cuales pasan a poseer una velocidad inicial igual a cero, la cual va aumentando hasta igualarse con la velocidad de los reactivos. En ese momento, las velocidades permanecerán iguales y constantes al igual que sus concentraciones. Y cuando las velocidades de los productos y de los reactivos llegan a este punto, podemos decir que la reacción está en equilibrio.
En la naturaleza hay muchos procesos reversibles, es decir, procesos que se dan en dos sentidos contrarios. Así, a nivel macroscópico, son ejemplos de procesos reversibles la sublimación de un sólido en un recipiente cerrado, y la evaporación de un líquido en dicho recipiente. Y a nivel submicrooscopico podemos hablar del proceso que realiza el monóxido de nitrógeno al interaccionar con el oxígeno para formar dióxido de nitrógeno, y este a su vez rompe sus enlaces intramoleculares para formar de nuevo los reactivos iniciales mencionados anteriormente. En estas reacciones se llega a un equilibrio en donde la concentración tanto de productos como de reactivos se mantiene igual y constante.